2016-11-21 22:45 |
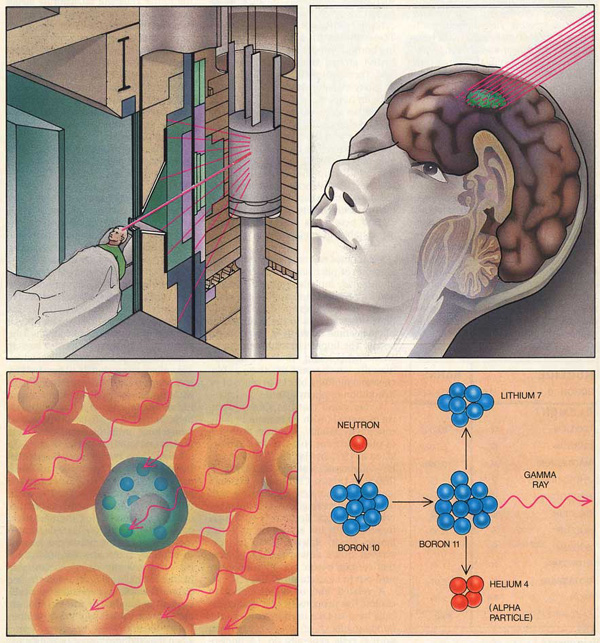
При борьбе с онкологическими заболеваниями цель врачей - наиболее эффективно уничтожить опухолевые клетки, по возможности избегая повреждений здоровых клеток организма. Один из существующих способов это сделать носит название нейтронозахватной терапии.
В 1936 году, всего спустя четыре года после открытия нейтрона Джеймсом Чедвиком, в «Американском журнале рентгенологии и радиотерапии» появилась статья «Биологические эффекты и терапевтические возможности нейтронов». Ее автор Дж. Л. Лоукер (G. L. Locher) из Института Франклина в Пенсильвании сформулировал основные принципы нейтронозахватной терапии. Он опирался на работу физика Тейлора, который в 1935 году установил, что атомы изотопа бора-10 хорошо поглощают нейтроны, под действием которых происходят ядерные реакции, сопровождающиеся большим выделением тепловой энергии. По мнению Лоукера, эффективным методом борьбы с раком могло бы стать введение в организм пациента препаратов, содержащих бор, которые должны накапливаться в клетках опухоли, и последующее облучение опухолевых клеток потоком нейтронов. Тогда из-за выделяющейся энергии клетки опухоли должны погибнуть. К достоинствам бора-10 относилось также и то, что он нетоксичен для организма.
Изотоп бор-10 составляет примерно одну пятую часть природного бора, он нерадиоактивен. При облучении нейронами соответствующей энергии ядро бора-10 превращается в бор-11, который через 10−12 секунды распадается на альфа-частицу (ядро гелия-4) и литий-7 высокой энергии.
10B + n → [11B] *→ α + 7Li + 2,31 МэВ
Альфа-частица и ядро лития-7 пролетают не более 5-9 мкм, что меньше размера опухолевой клетки, так что вся их ионизирующая энергия выделяется внутри нее. Так что эффективность воздействия значительным образом зависит от того, насколько различается концентрация бора-10 в клетках опухоли и в окружающей нормальной ткани. Если в здоровых клетках бора будет очень мало, а в опухоли много, то разрушение опухоли не нанесет ущерба остальному организму.
Первая реализация такого способа лечения последовала уже после Второй мировой. В 1951 году о предложенном Лоукером методе вспомнил доктор Уильям Свит из Массачусетского госпиталя (Massachusetts General Hospital) при Гарвардском университете. Свит обосновал применение нейтронозахватной терапии для лечения злокачественных опухолей мозга. И только в 1954 году состоялся первый эксперимент. Ученые из Брукхейвенской национальной лаборатории в Лонг-Айленде и Массачусетского госпиталя впервые применили изотоп бора-10 для лечения глиобластомы. В качестве источника нейтронов использовался ядерный реактор Массачусетского технологического института. После этого эксперимента сочли, что новый метод не эффективней традиционной терапии, поэтому других клинических испытаний в США не проводили до 1990-х.
Независимо этот метод терапии начали испытывать и в СССР, где подобные эксперименты в 1950-х годах занимался врач и изобретатель Анатолий Качугин. Во второй половине XX века эксперименты по нейтронозахватной терапии делались также в странах Европы и Японии, но только японские врачи стали использовать ее в хотя бы относительно массовой практике. Начал эту работу в 1967 году доктор Хироси Хатанака из Университета Тэйкё. Он оперировал больных с опухолями мозга, вырезая хирургически основную часть опухоли, а затем вводил в кровь им борокаптат натрия (Na2B12H11SH), который обладал свойством накапливаться в клетках опухоли. После этого Хатанака, используя ядерный реактор в качестве источника нейтронов, облучал нейтронами опухоли, избавляясь от оставшихся раковых клеток, которые могли бы дать метастазы. Таким образом Хатанака и его сподвижник Накагава вылечили более двухсот пациентов.
Бор-нейтронозахватная терапия
В 1990-е годы в США Гарвардский университет и Массачусетский технологический институт совместно с Брукхейвенской национальной лабораторией вернулись к экспериментам. В качестве носителя атомов бора они впервые начали использовать не борокаптат натрия, а борфенилаланин (BPA), а также применили для облучения опухоли не поток тепловых нейтронов с невысокой энергией (менее 0,5 эВ), а эпитепловые нейтроны (от 5 эВ до 10 кэВ), которые более эффективно проникают в ткани. Метод оказался безопасным для пациентов, но опять-таки испытания показали, что его эффективность не превзошла обычные способы лечения.
В конце 1990-х - начале 2000-х годов новые клинические испытания были проведены двумя группами японских ученых. Коллектив под руководством Миятаке и Кавабаты работал с исследовательском реактором университета Киото и применял комбинацию борокаптата натрия и борфенилаланина. Группа Ямамото использовала ядерный реактор Японского агентства по ядерной энергии в Цукубе. В обоих случаях оказалось, что наилучший результат дает применение как нейтронозахватной терапии, так и облучения рентгеновскими лучами. В 2000-х годах клинические испытания по применения нейтронозахватной терапии опухолей головного мозга велись также в Нидерландах, Швеции и Финляндии. Применении более совершенных препаратов бора и эпитепловых нейтронов увеличило эффективность терапии. Японские и тайваньские врачи проводили также испытания нейтронозахватной терапии экстракраниальных опухолей головы и шеи. Группы Ютаки Мисимы из Университета Кобе и Дзюнъити Хирацуки из больницы Медицинской школы Кавасаки, а также аргентинские врачи независимо друг от друга провели испытания нейтронозахватной терапии меланомы, получив впечатляющие результаты. Также были проведены пока единичные эксперименты по лечению таким способом колоректального рака.
В России в начале 2000-х тоже возобновили эксперименты по нейтронозахватной терапии. Они проводились на животных. Так, пятнадцать лет назад в эксперименте на ядерном реакторе МИФИ был вылечен от рака губы спаниель.
Собака после терапии, проведенной на ядерном реакторе в МИФИ 15 лет назад. Источник фото - журнал «Природа»
Итак, для нейтронозахватной терапии необходимо выполнить два важных условия. Во-первых, надо создать препарат, который будет содержать бор-10 (рассматривается применение других изотопов, например гадолиния-157, но пока бор-10 остается основным, поэтому метод обычно называют бор-нейтронозахватной терапией, БНЗТ). Желательно, чтобы содержание бора в этом препарате было бы максимально высоким. Также нужно, чтобы он избирательно накапливался в опухолевых клетках, а не в других клетках пациента. Наконец, препарат должен быть безопасен для здоровья. Во-вторых, необходимо иметь источник нейтронов. В проводившихся ранее экспериментах в этом качестве служили реакторы, что не всегда удобно, да и вряд ли можно планировать широкое распространение такого метода, ведь в каждую больницу реактор не поставить. Поэтому сейчас ученые создают другой тип источников терапевтических нейронов - ускорители. Очевидно, что, чтобы довести этот метод до практического применения, необходимы усилия как медиков, так и химиков, и физиков.
На прошлой неделе три российских академических института: Институт биоорганической химии имени академиков М. М. Шемякина и Ю. А. Овчинникова РАН, Новосибирский Института органической химии СО РАН и Институт ядерной физики СО РАН - опубликовали совместный пресс-релиз, где рассказали о проводящихся их учеными работах по совершенствованию метода бор-нейтронозахватной терапии. По словам заведующего лабораторией ИБХ РАН Алексея Валерьевича Феофанова, эксперименты по оптимизации накопления бора в раковых клетках ведутся в ИБХ РАН более пяти лет. «Перед нами стояла нетривиальная задача - найти способ внутриклеточной доставки более 1 миллиарда атомов бора на клетку. Такая концентрация бора требуется для эффективной бор-нейтронозахватной терапии. Решение было найдено путем разработки конъюгатов хлорина е6 с наночастицами бора. Хлорин е6 уже успешно используется для лечения онкологических заболеваний, и, как оказалось, способен доставлять в клетки наночастицы бора. Мы сумели в сотни раз повысить способность этих соединений проникать в цитоплазму раковых клеток. Измерения показали, что такие конъюгаты обеспечивают доставку нескольких миллиардов атомов бора на клетку, что позволяет говорить о перспективности их использования в БНЗТ,» - рассказал ученый. О достигнутых результатах Алексей Феофанов и его коллеги рассказали в статье, опубликованной журналом Photochemical & Photobiological Sciences.
Ученые из Новосибирского института органической химии имени Н. Н. Ворожцова СО РАН (НИОХ СО РАН) в то же время работают над организацией производства уже показавшего себя в ряде клинических испытаний за рубежом борфенилаланина. Сейчас это вещество производится только в Японии и Чехии, а без него трудно рассчитывать на внедрение метода БНЗТ в клиническую практику.
В лаборатории ведущего научного сотрудника ИЯФ СО РАН, доктора физико-математических наук Сергея Юрьевича Таскаева создан ускоритель, который должен служить источником потока нейтронов при БНЗТ, придя на смену ядерным реакторам. Ученые надеются, что им удастся в ближайшем будущем начать клинические испытания этого метода в России. Сейчас в рамках конкурса прорывных проектов «Программы 5-100» министерства образования и науки Российской Федерации обсуждается предложение создать клинику БНЗТ на базе Новосибирского государственного исследовательского университета.
.Аналог Ноткоин - TapSwap Получай Бесплатные Монеты
Подробнее читайте на polit.ru
| Источник: polit.ru | Рейтинг новостей: 263 |